Menenal Tanaman Krisan
Krisan merupakan tanaman bunga hias berupa perdu dengan sebutan lain Seruni atau Bunga emas (Golden Flower) berasal dari dataran Cina. Krisan kuning berasal dari dataran Cina, dikenal dengan Chrysanthenum indicm (kuning), C. morifolium (ungu dan pink) dan C. daisy (bulat, ponpon). Di Jepang abad ke-4 mulai membudidayakan krisan, dan tahun 797 bunga krisan djadikan sebagai simbol kekaisaran Jepang dengan sebutan Queen of The East. Tanaman krisan dari Cina dan Jepang menyebar ke kawasan Eropa dan Perancis tahun 1795. Tahun 1808 Mr. Colvil dari Chelsa mengembangkan 8 varietas krisan di Inggris. Jenis atau varietas krisan modern diduga mulai ditemukan pada abad ke-17. Krisan masuk ke Indonesia pada tahun 1800. Sejak tahun 1940, krisan dikembangkan secara komersial.
Klasifikasi botani tanaman hias krisan adalah sebagai berikut: Divisi: Spermathophyta
Sub Divisi : Angiospermae Famili : Asteraceae
Genus : Chrysanthemum Species : C. morifolium Ramat, C. indicum, C. daisy dll.
Jenis dan varietas tanaman krisan di Indonesia umumnya hibrida berasal dari Belanda, Amerika Serikat dan Jepang. Krisan yang ditanam di Indonesia terdiri atas: a) Krisan lokal (krisan kuno) Berasal dari luar negri, tetapi telah lama dan beradaptasi di Indoenesia maka dianggap sebagai krisan lokal. Ciri-cirinya antara lain sifat hidup di hari netral dan siklus hidup antara 7-12 bulan dalam satu kali penanaman. Contoh C. maximum berbunga kuning banyak ditanam di Lembang dan berbunga putih di Cipanas (Cianjur). b) Krisan introduksi (krisan modern atau krisan hibrida) Hidupnya berhari pendek dan bersifat sebagai tanaman annual. Contoh krisan ini adalah C. indicum hybr. Dark Flamingo, C. i.hybr. Dolaroid,C. i. Hybr. Indianapolis (berbunga kuning) Cossa, Clingo, Fleyer (berbunga putih), Alexandra Van Zaal (berbunga merah) dan Pink Pingpong (berbunga pink). c) Krisan produk Indonesia Balai Penelitian Tanaman Hias Cipanas telah melepas varietas krisan buatan Indonesia yaitu varietas Balithi 27.108, 13.97, 27.177, 28.7 dan 30.13A
Kegunaan tanaman krisan yang utama adalah sebagai bunga hias. Manfaat lain adalah sebagai tumbuhan obat tradisional dan penghasil racun serangga. Sebagai bunga hias, krisan di Indonesia digunakan sebagai: a) Bunga pot Ditandai dengan sosok tanaman kecil, tingginya 20-40 cm, berbunga lebat dan cocok ditanam di pot, polibag atau wadah lainnya. Contoh krisan mini (diameter bunga kecil) ini adalah varietas Lilac Cindy (bunga warna ping keungu-unguan), Pearl Cindy (putih kemerah-merahan), White Cindy (putih dengan tengahnya putih kehijau-hijauan), Applause (kuning cerah), Yellow Mandalay (semuanya dari Belanda).Krisan introduksi berbunga besar banyak ditanam sebagai bunga pot, terdapat 12 varitas krisan pot di Indonesia, yang terbanyak ditanam adalah varietas Delano (ungu), Rage (merah) dan Time (kuning). b) Bunga potong Ditandai dengan sosok bunga berukuran pendek sampai tinggi, mempunyai tangkai bunga panjang, ukuran bervariasi (kecil, menengah dan besar), umumnya ditanam di lapangan dan hasilnya dapat digunakan sebagai bunga potong. Contoh bunga potong amat banyak antara lain Inga, Improved funshine, Brides, Green peas, Great verhagen, Puma, Reagen, Cheetah, Klondike dll. Daerah sentra produsen krisan antara lain: Cipanas, Cisarua, Sukabumi, Lembang (Jawa Barat), Bandungan (Jawa Tengah), Brastagi (Sumatera Utara).
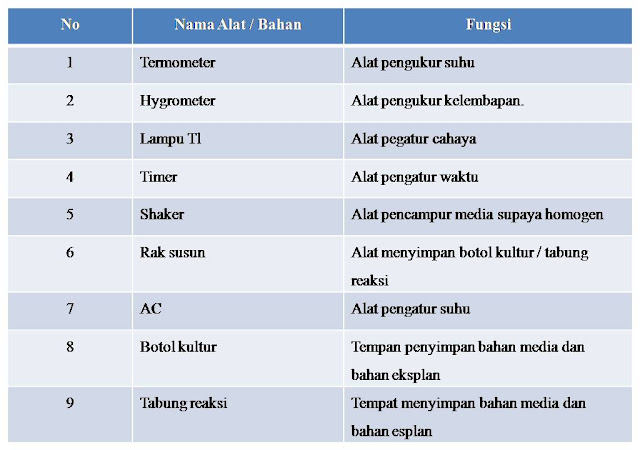
Tanaman krisan membutuhkan air yang memadai, tetapi tidak tahan terhadap terpaan air hujan. Oleh karena itu untuk daerah yang curah hujannya tinggi, penanaman dilakukan di dalam bangunan rumah plastik. 2) Untuk pembungaan membutuhkan cahaya yang lebih lama yaitu dengan bantuan cahaya dari lampu TL dan lampu pijar. Penambahan penyinaran yang paling baik adalah tengah malam antara jam 22.30–01.00 dengan lampu 150 watt untuk areal 9 m2 dan lampu dipasang setinggi 1,5 m dari permukaan tanah. Periode pemasangan lampu dilakukan sampai fase vegetatif (2-8 minggu) untuk mendorong pembentukan bunga. 3) Suhu udara terbaik untukdaerah tropis seperti Indonesia adalah antara 20-26 derajat C. Toleran suhu udara untuk tetap tumbuh adalah 17-30 derajat C. 4) Tanaman krisan membutuhkan kelembaban yang tinggi untuk awal pembentukan akar bibit, setek diperlukan 90-95%. Tanaman muda sampai dewasa antara 70- 80%, diimbangi dengan sirkulasi udara yang memadai. 5) Kadar CO2 di alam sekitar 3000 ppm. Kadar CO2 yang ideal untuk memacu fotosistesa antara 600-900 ppm. Pada pembudidayaan tanaman krisan dalam bangunan tertutup, seperti rumah plastik, greenhouse, dapat ditambahkan CO2, hingga mencapai kadar yang dianjurkan.
Perbanyak Dengan Kultur Jaringan
Kultur jaringan merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, sekelompok sel, jaringan dan organ , serta menumbuhkannya dalam keadaan aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali.
Tujuan kegiatan kultur jaringan adalah perbanyakan masal tanaman yang biasanya sangat lambat dengan metoda konvensional dalam jumlah yang besar dalam waktu yang singkat, selain itu diperoleh tanaman yang bebas virus, membantu pemulian tanaman untuk mempercepat pencapaian tujuan penelitian pada tanaman yang biasa diperbanyak secara vegetatif
Langkah-langkah Kultur Jaringan Pada Krisan
Pengambilan eksplan atau sumber eksplan krisan berupa pucuk dan nodus berasal dari tanaman induk krisan di rumah kaca perbenihan Balithi Segunung dan planlet di laboratorium kultur jaringan Balithi Segunung. Pembuatan Media MS Media yang digunakan untuk tanaman krisan di Balithi Segunung adalah media induksi tunas dan media perbanyakan. Komposisi media yang digunakan untuk induksi tunas adalah½ MS + 0.5 IAA komposisi media yang digunakan untuk perbanyakan adalah½ MS + 0.1 IAA Menyiapkan Eksplan Dalam perbanyakan tanaman secara kultur jaringan eksplan merupakan factor penting penentu keberhasilan. Hal-hal yang harus dipertimbangkan dalam pemilihan sebagai bahan kultur adalah jenis tanaman, bagian tanaman yang digunakan, morfologi permukaan, lingkungan tumbuhnya, kondisi tanaman, dan musim waktu mengambilnya. Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang aktif karena mempunyai regenerasi yang tinggi.
Eksplan yang digunakan pada tanaman krisan adalah nodus karena untuk menginduks tunas aksilar. Kultur Aseptik Krisan Sterilisasi Sterilisasi merupakan kegiatan untuk menghilangkan kontaminan organisme yang menempel di permukaan eksplan. Tujuan utama tahap ini adalah mengusahakan kultur yang aseptik dan aksenik. Aksenik berarti bebas dari mikroorganisme yang tidak diinginkan, sedangkan aseptic berarti bebas dari mikroorganisme.
Pemilihan Dan Penyipan Tanaman Induk
Sebelum melakukan kultur jaringan untuk suatu tanaman kegiatan pertama harus dilakukan adalah memilih tanaman induk yang hendak diperbanya. Seleksi untuk mendapatkan klon-klon yang dikehendaki. Klon yang mempunyai sifat beda, unik, stabil dan seragam kemudian dijadikan tanaman induk tunggal dan sebagai tanaman donor (bahan eksplan) untuk perbanyakan secara in vitro. Planlet (tanaman) hasil dari perbanyakan in vitro kemudian diaklimatisasi di rumah kaca. Setelah tanaman beradaptasi dengan lingkungan rumah kaca kemudian diperbanyak untuk keperluan tanaman induk yang akan menghasilkan tanaman produksi.
Penting sekali untuk lingkungan tanamn induk tersebut harus heginis untuk mendapatkan eksplan yang berkualitas dan lebih bersih untuk pembiakan in-vintro.
Pengerjaannya dilakukan dalam ruang laminar agar terhindar dari kontaminan. Penanamannya dikelompokkan berdasarkan nomor ruas. Setiap botol diisi 5 eksplan dan diulang empat kali. Botol kultur selanjutnya diinkubasi dalam ruang pertumbuhan dengan pencahayaan 16 jam di bawah lampu fluoresen 40 watt, suhu 24-26 oC, dan kelembapan 60-80% hingga eksplan tumbuh menjadi planlet (tanaman hasil kultur jaringan yang telah lengkap memiliki bagian-bagian tanaman yang meliputi akar, batang, dan daun)
Cara Sterilisasi Untuk Tanaman Krisan
• Mengambil eksplan yang telah diseleksi berdasarkan ketahanan vigor, hama penyakit, dan jumlah daun 4 - 5 helai atau 3 - 4 nodus.
• Memotong eksplan per nodus dengan mengurangi atau memotong sebagian helai daun.
• Eksplan direndam dalam larutan Benlatte dan Bactomicyn (fungisida dan bakterisida), masing-masing sebanyak 1 g/300 ml aquades sambil dikocok-jocok selama 30 menit.
• Membilas eksplan dengan air aquadest sebanyak 4 - 5 kali.
• Selanjutnya eksplan dibawa ke laminar.
• Eksplan dimasukkan ke dalam larutan tween 2 tetes/100 ml aquades sambil dikocok-kocok selama 5 menit.
• Eksplan dimasukkan ke dalam larutan Chlorox 0.5 % selama 5 menit sambil dikocok-kocok.
• Selanjutnya eksplan dimasukkan ke dalam larutan Chlorox 1 % selama 3 menit sambil dikocok-kocok.
• Eksplan dibilas dengan air destilasi sebanyak 5 - 6 kali.
Penanaman Eksplan Kegiatan dan Media Tanam
Penanaman eksplan ke dalam botol kultur disebut dengan inokulasi. Kegiatan ini dilakukan setelah eksplan disterilisasi, diawali dengan memotong bagian permukaan eksplan. Selanjutnya eksplan berupa nodus ditanam sebanyak dua buah dalam media ½ MS + IAA 0.5 mg/l, sedangkan eksplan berupa pucuk tidak perlu ditanam, cukup diletakkan saja pada media yang sama sebanyak 3 buah. Sebelum ditutup dengan plastik wrap, plastik transparan, dan karet, botol media yang telah ditanami terlebih dahulu dipanaskan di atas api bunsen. Selanjutnya botol diberi label jenis tanaman dan tanggal penanaman. Eksplan yang telah dikulturkan dibawa ke ruang inkubasi dan dibiarkan sampai tumbuh.
Multiplikasi
Cutting atau Multipikasi bertujuan untuk memperbanyak propagul sedangkan, Sub kultur adalah usaha untuk menggantikan media dalam kultur jaringan dengan media yang baru, sehingga kebutuhan nutrisi untuk pertumbuhan kalus dapat terpenuhi. Berikut ini adalah uraian tentang teknik pelaksaan sub kultur pada media padat. Dari media pertama, kultur dipindahkan ke media regerasi selama sekitar tiga minggu. Setelah itu, apabila kita bertujuan untuk memperbanyak propagul atau multifikasi,maka kita lakukan pemindahan media baru dan apabila tanamannya berbatang maka kita lakukan stek/ cutting contohnya pada tanaman krisan kita perbanyak dengan cara memotong perbuku. Atau per dua buku tergantung titik tumbuh daun, yang akan menjadi cabang baru.
Namun biasanya cuttig krisan dilakukan stelah tanamn tumbuh sempurna dan besar. Hal ini untuk memeudahkan perbanyakan, sehingga dapat memeprbanyak tanpa batas.
Tunas-tunas hasil perbanyakan di laboratorium kultur jaringan diseleksi untuk memperoleh tunas yang pertumbuhannya sehat, vigor baik, dan tidak menunjukkan gejala penyimpangan. Tunas terpilih kemudian dikeluarkan dari botol secara hati-hati dengan menggunakan pisau skalpel, kemudian dipotong tiap ruas/buku dari ruas 1 sampai 4. Pemotongan dilakukan di dalam petridis menggunakan pisau kultur. Bagian tanaman yang digunakan adalah pucuk atau ruas 1, 2, 3, dan 4. dan stelah itu dimasukan kedalam media sub kultur dengan media ½ MS + 0.5 IAA.Pembentukan akar umumnya dimulai dengan pemindahan indol acetic acid (IAA) yang diproduksi pucuk tanaman ke bagian batang yang luka untuk menstimulasi pembentukan akar (Brenner et al. 1987).
Setelah pomotongan, umumnya setek tidak sensitif terhadap hormon. Pada fase ini terjadi dediferensiasi, sel-sel menjadi kompeten dan responsif terhadap hormon. Setelah itu sel-sel aktif membelah (bersifat meristematik) diikuti dengan pembentukan primordia akar, pembentukan akar hingga akar tumbuh dan berkembang (De Klerk et al. 1999). Auksin umumnya berperan penting dalam inisiasi pembentukan akar. Peran auksin akan optimal bila faktor lingkungan juga optimal.
Aklimatisasi
Aklimatisasi merupakan kegiatan akhir teknik kultur jaringan. Aklimatisasi adalah proses pemindahan planlet dari lingkungan yang terkontrol ke kondisi lingkungan tak terkendali, baik suhu, cahaya, dan kelembaban. Aklimatisasi dilakukan untuk mengadaptasikan tanaman hasil kultur jaringan terhadap lingkungan baru sebelum ditanam dan dijadikan tanaman induk untuk produksi dan untuk mengetahui kemampuan adaptasi tanaman dalam lingkungan tumbuh yang kurang aseptik.
Perubahan kondisi lingkungan yang drastis, dari lingkungan terkontrol ke tidak terkontrol, dari suhu relatif stabil ke suhu lingkungan yang fluktuatif, dari kelembapan tinggi ke rendah dan fluktuatif, dan dari cahaya rendah ke cahaya tinggi pada umumnya menyebabkan tanaman mudah mengalami cekaman atau stres, kehilangan air, layu, dan mati Oleh karena itu, proses aklimatisasi perlu dilakukan secara bertahap, seperti yang diterapkan Winarto (2002) pada anyelir. Aklimatisasi akan membantu tanaman beradaptasi terhadap perubahan kondisi lingkungan seperti suhu, kelembapan, dan intensitas cahaya.
Metode aklimatisasi dibagi menjadi 2, yaitu metode langsung (direct) dan metode tidak langsung (indirect).
Metode langsung:
1.Menyiapkan planlet dalam botol yang akan diaklimatisasi dan mengeluarkan planlet secara hati-hati dari dalam botol.
2.Membersihkan akar tanaman dari agar-agar yang masih melekat dengan air.
3.Merendam akar tanaman dalam larutan fungisida dan bakterisida selama 5 menit.
4.Menanam tanaman pada bak media arang sekam yang telah dibasahi.
5.Tutup bak dengan plastik transparan selam 1 - 2 minggu.
6.Setelah 1 -2 minggu plastik dibuka dan tanaman dibiarkan tumbuh dan berkembang dalam bak aklimatisasi hingga minggu ketiga sampai keempat.
7.Selanjutnya tanaman dipindahkan ke dalam polibag-polibag kecil sampai siap untuk di tanam di lapang.
Metode tidak langsung:
1.Menyiapkan planlet dalam botol yang akan diaklimatisasi dan mengeluarkan planlet secara hati-hati dari dalam botol
2.Memotong tanaman tepat pada bagian bawah nodus ketiga kemudian merendamnya dalam larutan fungisida dan bakterisida selama 5 menit.
3.Menanam tanaman pada bak media arang sekam yang telah dibasahi.
4.Tutup bak dengan plastik transparan selam 1 - 2 minggu.
Aklimatisasi Planlet di Rumah Kaca Aklimatisasi merupakan tahap penting dalam proses kultur jaringan. Tahap ini sering kali menjadi titik kritis dalam aplikasi teknik kultur jaringan. Aklimatisasi diperlukan karena tanaman hasil kultur jaringan umumnya memiliki lapisan lilin tipis dan belum berkembang dengan baik, sel-sel dalam palisade belum berkembang maksimal, jaringan pembuluh dari akar ke pucuk kurang berkembang, dan stomata sering kali tidak berfungsi, yaitu tidak dapat menutup pada saat penguapan tinggi.
read more...